Aan dit artikel is enkele uren gewerkt. Opzoeken, vertalen, plaatsen enz. Als u ons wilt ondersteunen dan kan dat via een al of niet anonieme donatie. Elk bedrag is welkom hoe klein ook. Klik hier als u ons wilt helpen kanker-actueel online te houden Wij zijn een ANBI organisatie en dus is uw donatie aftrekbaar voor de belasting.
25 maart 2015: Bron: The University of Texas MD Anderson Cancer Center
Een nieuw ontwikkelde aanpak (MD Andersen Algoritme) door een beoordeling via een kijkoperatie door twee of drie chirurgen onafhankelijk van elkaar in samenwerking met een multidisciplinair team van artsen voor het bepalen van de volgorde van chemo en / of operatie door een chirurgenteam aan The University of Texas MD Anderson Cancer Center verbetert spectaculair de volledige verwijdering van de tumoren bij eierstokkanker.
Sinds de chirurgen begonnen met de introductie van het Anderson Algoritme, het cijfer van complete resecties - alle tumorweefsel kon worden weggehaald - steeg voor eerst een operatie van 20% naar 80%. Voor de operaties waarvoor eerst chemotherapie werd toegepast steeg de complete resectie van 60% naar 86%.
Dit nieuwe algoritme selecteerde de helft van de patiënten voor elk van de behandelingen. De artsen hebben dit algoritme, deze aanpak, voor 95% toegepast sinds de introductie 2 jaar geleden in het MD Andersen Cancer Center.
Met deze aanpak wordt indirect ook de overall overleving van eierstokkankerpatiënten sterk verbetert. Overall bleek uit deze studie dat er weinig tot geen verschil zat in de overleving tussen de twee groepen, dus of eerst chemo of eerst operatie, maar bij de patiënten die een complete verwijdering hadden bleek de overall overleving sterk verbetert, verdeeld over beide groepen.
Hoe simpel kan het dus zijn. Als je dan bedenkt dat er tegenwoordig ook technieken zijn waarmee met fluorescerende stofjes achtergebleven cellen kunnen worden aangetoond en eventueel verwijderd dan zou het toch makkelijk en mogelijk moeten zijn om elke operatie op deze manier te benaderen?
Sterk verbeterde complete resecties:
Sinds de chirurgen het Anderson Algoritme hebben ingevoerd bleek het cijfer voor complete resecties - volledige verwijdering van alle tumorweefsel - middels eerst een operatie gestegen van 20% naar 88%. Voor patiënten die eerst chemo hadden gekregen en daarna een operatie bleek het cijfer voor een complete resectie gestegen van 60% naar 86%. Behandelend artsen in het Andersen hebben na de invoering bij 95% van de patiënten deze nieuwe aanpak en aanbevelingen toegepast.
Deze studie bewijst dat een volledige verwijdering van tumorweefsel bij eierstokkanker een sterke prognose heeft op de overall overleving. Bijvoorbeeld data van 7 clinische trials verdeeld over meerdere ziekenhuizen bewijst dat patiënten die geen zichtbare resttumoren hadden na operatie een mediane overleving hadden van 64 maanden tegenover 29 maanden voor die patiënten die minimale resttumoren hadden na operatie. (Mijn opmerking hierbij: eierstokkanker heeft een sterke kans op een recidief omdat de PD functie (Programmed Death functie) bij vormen van eierstokkanker meestal zijn verstoord. Anti-PD medicijnen, zouden dit kunnen tegengaan. Maar dit terzijde.)
Andere grote studies hebben ook bewezen dat als bij eierstokkanker alle tumorweefsel kan worden weggehaald de kans op een recidief veel kleiner is en overleven vele malen groter is dan wanneer er tumorweefsel blijft zitten, zelfs als dat tumorweefsel weinig is. Zie o.a. deze reviewstudie van het Cochrane Instituut: Optimal primary surgical treatment for advanced epithelial ovarian cancer
En zie ook onderaan artikel referentielijst. Of lees ook dit artikel:
Authors' conclusions
During primary surgery for advanced stage epithelial ovarian cancer all attempts should be made to achieve complete cytoreduction. When this is not achievable, the surgical goal should be optimal (< 1 cm) residual disease. Due to the high risk of bias in the current evidence, randomised controlled trials should be performed to determine whether it is the surgical intervention or patient-related and disease-related factors that are associated with the improved survival in these groups of women. The findings of this review that women with residual disease < 1 cm still do better than women with residual disease > 1 cm should prompt the surgical community to retain this category and consider re-defining it as 'near optimal' cytoreduction, reserving the term 'suboptimal' cytoreduction to cases where the residual disease is > 1 cm (optimal/near optimal/suboptimal instead of complete/optimal/suboptimal).
Alpa Nick, MD, Assistant Professor of Gynecologic Oncology, en collega's merken op dat een CT-scan en analyse van bloedmarkers waaronder de CA-125 die voor eierstokkanker vaak wordt gebruikt, niet voldoende een prognose geven of eerst een operatie effectief zou kunnen zijn.
Deze studie toont aan dat een kijkoperatie - laparoscopy wel een belangrijke prognose geeft op de kansen op overall overleving.
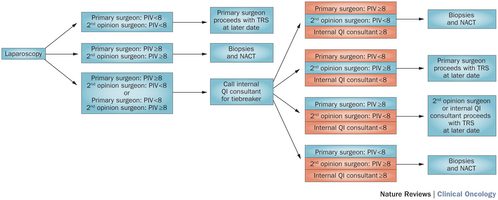
Anna Fagotti, MD, en collega's aan het Catholic University of the Sacred Heart in Rome, ontwikkelden een voorspellende index gebaseerd op de aanwezigheid van ziektesymptomen vast te stellen door een kijkoperatie - laparoscopy bij 7 andere organen. Een score lager dan 8 geeft aan dat eerst een operatie veilig en effectief kan worden uitgevoerd. Is de score 8 of hoger dan wordt eerst chemotherapie gegeven en daarna gevolgd door een operatie.
“Eierstokkanker verspreid zich als het ware als een coating - bedekkingslaagje - over andere organen, waardoor een CT-scan onvoldoende kan aantonen dat er sprake is van tumorweefsel.” aldus Dr. Nick. “Een kijkoperatie - laparoscopy geeft een beter zicht op eventueel aanwezige tumorweefsel en stadium van de ziekte.”
Wat houdt het Andersen algoritme in?
- Diagnostische kijkoperatie - laparoscopy wordt uitgevoerd bij alle patiënten met verdenking van uitgezaaide eierstokkanker die geschikt zijn voor een operatie. .
- Twee chirugen beoordelen onafhankelijk van elkaar het beeld van de kijkoperatie en geven hun mening onafhankelijk van elkaar of eerst een operatie zou kunnen of eerst chemo nodig is.
- Een derde onafhankelijke chirurg wordt gevraagd ook een mening te geven als de twee chirurgen van mening verschillen.
- Patienten met scores onder 8 komen in aanmerking voor een operatie. Patiënten met een score van 8 of hoger wordt eerst drie chemokuren gegeven en pas daarna geopereerd.
Tot zover waren de eerste twee chirurgen voor 98% eensluidend in hun mening.
Het volledige studierapport: A framework for a personalized surgical approach to ovarian cancer is tegen betaling in te zien.
Hier het abstract van die studie met een referentielijst:
A surgical algorithm developed and implemented by ovarian cancer specialists at The University of Texas MD Anderson Cancer Center dramatically increases the frequency of complete removal of all visible tumor—a milestone strongly tied to improved chances of survival.
- Nature Reviews Clinical Oncology
- doi:10.1038/nrclinonc.2015.26
- Published online
-
A framework for a personalized surgical approach to ovarian cancer
The standard approach for the treatment of advanced-stage ovarian cancer is upfront cytoreductive surgery followed by a combination of platinum-based and taxane-based chemotherapy. The extent of residual disease following upfront cytoreductive surgery correlates with objective response to adjuvant chemotherapy, rate of pathological complete response at second-look assessment operations, and progression-free survival and overall survival. Contemporary data and meta-analyses indicate a correlation between volume of residual disease and patient outcome, with those patients undergoing complete gross resection having the best outcomes. Thus, attention has focused on surgical efforts to remove as much disease as possible with the metric of 'optimal' cytoreduction being R0 disease. Because patients with R0 resection seem to have the best overall outcomes, preoperative or intraoperative assessment to avoid unnecessary primary debulking surgery has become common. The use of serum CA-125 levels, physical examination and CT imaging have lacked accuracy in determining if disease can be optimally debulked. Therefore, an algorithm that identifies patients in whom complete gross resection at primary surgery is likely to be achieved would be expected to improve patient survival. We discuss contemporary definitions of 'optimal' residual disease, and opportunities to personalize surgical therapy and improve the quality of surgical care.
References:
- , , , & Optimal primary surgical treatment for advanced epithelial ovarian cancer. Cochrane Database of Systematic Reviews, Issue 8. Art. No.: CD007565 http://dx.doi.org/10.1002/14651858.CD007565.pub2 (2011).
- & Intensive surgical and chemotherapeutic management of advanced ovarian cancer. Surg. Clin. North Am. 58, 131–142 (1978).
- et al. Relative influences of tumor volume before surgery and the cytoreductive outcome on survival for patients with advanced ovarian cancer: a prospective study. Gynecol. Oncol. 90, 390–396 (2003).
- , & Complete cytoreductive surgery is feasible and maximizes survival in patients with advanced epithelial ovarian cancer: a prospective study. Gynecol. Oncol. 69, 103–108 (1998).
- et al. What is the optimal goal of primary cytoreductive surgery for bulky stage IIIC epithelial ovarian carcinoma (EOC)? Gynecol. Oncol. 103, 559–564 (2006).
- et al. Aggressive surgical effort and improved survival in advanced-stage ovarian cancer. Obstet. Gynecol. 107, 77–85 (2006).
- , & Ovarian metastasis of breast cancer: a case report. Role of cytoreductive surgery . J. Gynecol. Obstet. Biol. Reprod. (Paris) 38, 242–245 (2009).
- et al. Intraperitoneal cisplatin plus intravenous cyclophosphamide versus intravenous cisplatin plus intravenous cyclophosphamide for stage III ovarian cancer. N. Engl. J. Med. 335, 1950–1955 (1996).
- , & A phase II trial of intravenous etoposide (VP-16-213) in epithelial ovarian cancer resistant to cisplatin or carboplatin: clinical and serological evidence of activity. Int. J. Gynecol. Cancer 2, 35–40 (1992).
- et al. The effect of diameter of largest residual disease on survival after primary cytoreductive surgery in patients with suboptimal residual epithelial ovarian carcinoma. Am. J. Obstet. Gynecol. 170, 974–979 (1994).
- , , & Survival effect of maximal cytoreductive surgery for advanced ovarian carcinoma during the platinum era: a meta-analysis. J. Clin. Oncol. 20, 1248–1259 (2002).
- et al. Prospective study of the correlation between postoperative computed tomography scan and primary surgeon assessment in patients with advanced ovarian, tubal, and peritoneal carcinoma reported to have undergone primary surgical cytoreduction to residual disease 1 cm or less. J. Clin. Oncol. 25, 4946–4951 (2007).
- et al. Frequent use of complex surgeries and survival outcomes in ovarian cancer: a propensity score analysis from the Korean Gynecologic Oncology Group . J. Clin. Oncol. 32 (Suppl.), a5537 (2014).
- et al. Improved progression-free and overall survival in advanced ovarian cancer as a result of a change in surgical paradigm. Gynecol. Oncol. 114, 26–31 (2009).
- et al. Tumor residual after surgical cytoreduction in prediction of clinical outcome in stage IV epithelial ovarian cancer: a Gynecologic Oncology Group Study. J. Clin. Oncol. 26, 83–89 (2008).
- et al. Role of surgical outcome as prognostic factor in advanced epithelial ovarian cancer: a combined exploratory analysis of 3 prospectively randomized phase 3 multicenter trials: by the Arbeitsgemeinschaft Gynaekologische Onkologie Studiengruppe Ovarialkarzinom (AGO-OVAR) and the Groupe d'Investigateurs Nationaux Pour les Etudes des Cancers de l'Ovaire (GINECO). Cancer 115, 1234–1244 (2009).
- , , & Interval debulking surgery for advanced epithelial ovarian cancer. Cochrane Database of Systematic Reviews, Issue 2. Art. No.: CD006014 http://dx.doi.org/10.1002/14651858.CD006014.pub4 (2009).
- et al. Neoadjuvant chemotherapy or primary surgery in stage IIIC or IV ovarian cancer. N. Engl. J. Med. 363, 943–953 (2010).
- et al. Chemotherapy or upfront surgery for newly diagnosed advanced ovarian cancer: results from the MRC CHORUS trial . J. Clin. Oncol. 31 (Suppl.), a5500 (2013).
- et al. An analysis of patients with bulky advanced stage ovarian, tubal, and peritoneal carcinoma treated with primary debulking surgery (PDS) during an identical time period as the randomized EORTC–NCIC trial of PDS vs neoadjuvant chemotherapy (NACT). Gynecol. Oncol. 124, 10–14 (2012).
- , , & Discordance between beliefs and recommendations of gynecologic oncologists in ovarian cancer management. Int. J. Gynecol. Cancer 14, 1055–1062 (2004).
- et al. The role of neoadjuvant chemotherapy in the management of patients with advanced stage ovarian cancer: survey results from members of the Society of Gynecologic Oncologists. Gynecol. Oncol. 119, 18–21 (2010).
- & Early detection of ovarian cancer. Dis. Markers 23, 397–410 (2007).
- , , & The ability of preoperative serum CA-125 to predict optimal primary tumor cytoreduction in stage III epithelial ovarian carcinoma. Gynecol. Oncol. 77, 227–231 (2000).
- et al. Can the preoperative CA-125 level predict optimal cytoreduction in patients with advanced ovarian carcinoma? A single institution cohort study. Gynecol. Oncol. 112, 11–15 (2009).
- , , & CA125 levels are a weak predictor of optimal cytoreductive surgery in patients with advanced epithelial ovarian cancer. Int. J. Gynecol. Cancer 13, 120–124 (2003).
- , , , & Preoperative serum CA125 levels do not predict suboptimal cytoreductive surgery in epithelial ovarian cancer. Int. J. Gynecol. Cancer 18, 621–628 (2008).
- et al. A study to evaluate the utility of presurgical CA125 to predict optimal tumor cytoreduction of epithelial ovarian cancer. Gynecol. Oncol. 105, 780–783 (2007).
- , , , & The utility of presurgical CA125 to predict optimal tumor cytoreduction of epithelial ovarian cancer. Int. J. Gynecol. Cancer 16, 496–500 (2006).
- et al. Predictors of suboptimal surgical cytoreduction in women treated with initial cytoreductive surgery for advanced stage epithelial ovarian cancer. Am. J. Obstet. Gynecol. 193, 568–574 (2005).
- et al. Preoperative predictors of suboptimal primary surgical cytoreduction in women with clinical evidence of advanced primary epithelial ovarian cancer. Int. J. Gynecol. Cancer 14, 42–50 (2004).
- et al. A retrospective study of preoperative CA 125 levels in 82 patients with ovarian cancer. Arch. Gynecol. Obstet. 269, 263–265 (2004).
- , & Can optimal primary cytoreduction be predicted in advanced stage epithelial ovarian cancer? Role of preoperative serum CA-125 level. Gynecol. Obstet. Invest. 57, 153–156 (2004).
- et al. CA-125 levels in predicting optimal cytoreductive surgery in patients with advanced epithelial ovarian carcinoma. Int. J. Gynaecol. Obstet. 84, 173–174 (2004).
- et al. Preoperative CA 125 levels: an independent prognostic factor for epithelial ovarian cancer. Obstet. Gynecol. 100, 59–64 (2002).
- et al. Can serum CA-125 levels predict the optimal primary cytoreduction in patients with advanced ovarian carcinoma? Gynecol. Oncol. 86, 57–61 (2002).
- , & Preoperative CA-125 level as a predictor of non optimal cytoreduction of advanced epithelial ovarian cancer. Acta Obstet. Gynecol. Scand. 80, 583–585 (2001).
- , & Preoperative abdominopelvic computed tomographic prediction of optimal cytoreduction in epithelial ovarian carcinoma. J. Clin. Oncol. 11, 166–172 (1993).
- , , , & Ovarian carcinoma: value of CT in predicting success of debulking surgery. AJR Am. J. Roentgenol. 165, 875–878 (1995).
- , , , & The utility of computed tomography scans in predicting suboptimal cytoreductive surgery in women with advanced ovarian carcinoma. Cancer 101, 346–352 (2004).
- et al. A model for predicting surgical outcome in patients with advanced ovarian carcinoma using computed tomography. Cancer 89, 1532–1540 (2000).
- et al. Multi-institutional reciprocal validation study of computed tomography predictors of suboptimal primary cytoreduction in patients with advanced ovarian cancer. J. Clin. Oncol. 25, 384–389 (2007).
- , , & Can pre-operative computed tomography predict resectability of ovarian carcinoma at primary laparotomy? BJOG 109, 369–375 (2002).
- et al. A multicenter prospective trial evaluating the ability of preoperative computed tomography scan and serum CA-125 to predict suboptimal cytoreduction at primary debulking surgery for advanced ovarian, fallopian tube, and peritoneal cancer. Gynecol. Oncol. 134, 455–461 (2014).
- , & Gene expression and prediction of complete cytoreduction in ovarian cancer. Obstet. Gynecol. 123 (Suppl. 1), 89S (2014).
- et al. Molecular biomarkers of residual disease after surgical debulking of high-grade serous ovarian cancer. Clin. Cancer Res. 20, 3280–3288 (2014).
- et al. A contemporary analysis of the ability of preoperative serum CA-125 to predict primary cytoreductive outcome in patients with advanced ovarian, tubal and peritoneal carcinoma. Gynecol. Oncol. 112, 6–10 (2009).
- et al. Factors associated with cytoreducibility among women with ovarian carcinoma. Gynecol. Oncol. 95, 377–383 (2004).
- et al. A multicenter study of CA 125 level as a predictor of non-optimal primary cytoreduction of advanced epithelial ovarian cancer. Eur. J. Surg. Oncol. 31, 1006–1010 (2005).
- et al. Role of laparoscopy to assess the chance of optimal cytoreductive surgery in advanced ovarian cancer: a pilot study. Gynecol. Oncol. 96, 729–735 (2005).
- et al. A laparoscopy-based score to predict surgical outcome in patients with advanced ovarian carcinoma: a pilot study. Ann. Surg. Oncol. 13, 1156–1161 (2006).
- et al. Prospective validation of a laparoscopic predictive model for optimal cytoreduction in advanced ovarian carcinoma. Am. J. Obstet. Gynecol. 199, 642. e1–e6 (2008).
- et al. Introduction of staging laparoscopy in the management of advanced epithelial ovarian, tubal and peritoneal cancer: impact on prognosis in a single institution experience. Gynecol. Oncol. 131, 341–346 (2013).
- US National Library of Medicine. ClinicalTrials.gov , (2013).
- The University of Texas MD Anderson Cancer Center. The Moon Shots Program , (2014).
- Personalized surgical therapy for advanced ovarian cancer. Presented at the 50th American Society of Gynecologic Oncology Annual Meeting (2014).
Author information
Competing interests statement
The authors declare no competing interests.
Author details
-
Alpa M. Nick, MD, is an Assistant Professor in the Department of Gynecologic Oncology at the University of Texas MD Anderson Cancer Center in Houston, TX, USA. Her main research interests include development of novel therapies, biomarkers and prognostic markers for ovarian cancer.
-
Robert L. Coleman, MD, completed his fellowship from 1993 at the University of Texas, MD Anderson Cancer Center. Upon completion of this fellowship, he joined the faculty of Creighton University Medical Center in Omaha, Nebraska where he directed the Division of Gynecologic Oncology from 1993 until 1996. He was recruited to the University of Texas Southwestern Medical Center, where he became active in clinical trial design and conduct, minimally invasive surgery and resident/fellowship surgical education. While at UTSWMC, he assumed the role of Vice Chair for Gynecology Services, which oversaw the administration of the Divisions of Gynecology, Gynecologic Oncology and Reproductive Medicine/Endocrinology. In 2004, he joined the faculty of MD Anderson to head the Department of Gynecologic Oncology's clinical research portfolio. His research interests include novel targeted therapeutics, independent drug discovery/manufacturing and scalable systems, and clinical trial design. He currently serves as the Department's Deputy Chair and holds the Ann Rife Cox Chair for Gynecology.
-
Pedro T. Ramirez, MD, is Professor and Director of Minimally Invasive Surgical Research and Education in the Department of Gynecologic Oncology at the University of Texas MD Anderson Cancer Center. His research interests include minimally invasive surgery and fertility-preservation among women with gynecologic malignancies.
-
Anil K. Sood, MD, is Professor and Vice Chairman of Translational Research in the Department of Gynecologic Oncology and has a joint appointment in the Department of Cancer Biology at the University of Texas MD Anderson Cancer Center. He is also Co-Director of the Center for RNA Interference and Non-Coding RNA, and Director of the Blanton-Davis Ovarian Cancer Research Program. His main research interests include RNA interference therapeutics, identification of mechanisms underlying the effects of neuroendocrine hormones on cancer metastasis, and development of new strategies for targeting angiogenesis. He is an elected fellow of the American Society for Clinical Investigation (ASCI) and American Association for the Advancement of Science (AAAS).
Gerelateerde artikelen
- Lymfklieren weghalen bij operatieve verwijdering van eierstokkanker geeft geen betere overall overleving maar wel meer ernstige complicaties en meer doden gerelateerd aan de operatie
- Debulkingoperatie tot 1 cm of minder plus chemotherapie of hipec geeft veel betere ziektevrije tijd en overall overleving bij recidief van eierstokkanker en primaire buikvlieskanker
- Nieuwe chirurgische aanpak via kijkoperatie welke de volgorde van chemo en / of operatie bepaalt verbetert spectaculair - 68% beter - de overall overleving van patiënten met eierstokkanker.
- Operatie: Cryosurgery (bevriezen of verhitten) van uitzaaiingen - ook in andere organen - blijkt voor uitstekende resultaten te zorgen op de overlevingsduur en kwaliteit van leven bij patienten met eierstokkanker stadium 3 en 4
- Lymfklieren weghalen bij operatieve verwijdering van eierstokkanker geeft geen betere overall overleving maar wel meer ernstige complicaties en meer doden gerelateerd aan de operatie copy 1
- Operatie bij recidief van eierstokkanker (2e operatieve ingreep dus) significant levensverlengend en succesvol uitgevoerd bij ca. 200 patiënten met recidief van eierstokkanker verdeeld over drie gerandomiseerde studies



Plaats een reactie ...
Reageer op "Nieuwe chirurgische aanpak via kijkoperatie welke de volgorde van chemo en / of operatie bepaalt verbetert spectaculair - 68% beter - de overall overleving van patiënten met eierstokkanker."